Synthese multivalent bindender Ligandensysteme via chemoselektiver Saccharid- und Peptid-Ligation
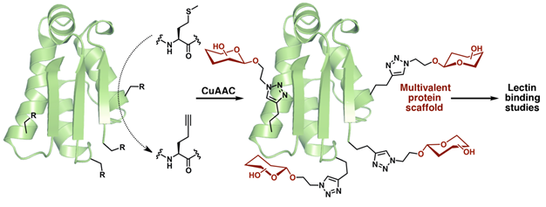
Durch die Kombination von unnatürlicher Proteinexprimierung und chemoselektiven Konjugationsmethoden ist es möglich, punktgenaue chemische Modifikationen an Proteinen vorzunehmen. Ziel des Teilprojekts B5 ist es die Programmierbarkeit und die inhärente Rigidität von proteinogenen Biopolymeren für die Multivalenzforschung zu nutzen. Dabei sollen bioaktive Liganden für Multivalenzstudien gezielt räumlich angeordnet werden. Dies geschieht durch die Positionierung einer definierten Anzahl von Liganden an der Oberfläche von fluoreszenten Proteinen (z.B. GFP) oder virusähnlichen Partikeln (z.B. des Bacteriophagen Qβ), welche durch auxotrophe Exprimierung und anschließende Konjugation mit Kohlenhydrat- oder Peptidliganden gewonnen werden. Wir erhoffen uns durch diese Studie ein tiefergehendes Verständnis multivalenter Bindungsphänomene, wobei die fluoreszenten Eigenschaften der Proteingerüste für den Nachweis multivalenter Bindungen in komplexen Systemen verwendet werden können.
In einer Kooperation mit dem Teilbereich B4 entwickeln wir Inhibitoren der Clathrin-vermittelten Endozytose. Diese Proben präsentieren multivalent Peptidmotive die z.B. an den Adaptorproteinkomplex AP-2 binden oder das Konnektorprotein EPS-15 nachahmen. Auf diese Weise soll die Assemblierung des endozytotischen Vesikelgerüsts unterbunden werden.